加齢を遅らせる?脳の視床下部で加齢を制御できる─科学者らが発見

Evgeny Atamanenko / Shutterstock.com
著:Richard Faragher(ブライトン大学 Professor of Biogerontology)
現在この記事を読んでおられる読者諸氏が喫煙しないとすれば主な死亡リスク要因はおそらく加齢だろう。これは、科学技術の進歩のおかげで、幼少期の死亡率はほぼゼロに近くなったからだ。ただし科学が進歩しても、人類は依然として加齢そのもののマイナスの効果を排除する方法を見出していない。
このたび『ネイチャー』誌に掲載された新たな報告で、マウスの脳の特定の領域にある幹細胞(他の多くのタイプの細胞に進化する能力をもつ細胞)が加齢を制御することが明らかになった。研究チームは、マウスのこの領域の幹細胞の移植または除去することにより、加齢のプロセスを抑制または進行の管理さえも行うことができた。
加齢は社会にとって重要な課題となっている。2050年までに世界の高齢者(65歳以上)と児童(15歳未満)の人口が初めて等しくなると予想されている。このような変化は人の健康と社会福祉システムに対する未曾有の圧力として反映されている。年齢を重ねるにつれて自分の健康の維持の方法を知ることはますます重要となってくる。
身体組織を健康に保つメカニズムは比較的数が少なく、種の間に保存されている。すなわち、マウスなどの動物を研究することによってそのメカニズムについて多くのことを知ることができるのだ。なかでも最も重要なのは、老化細胞だ。老化細胞は老化と共に組成されて組織に慢性の炎症や幹細胞の枯渇などの損傷を引き起こす機能不全細胞だ。そのメカニズムは細胞や組織レベルでつながっていると考えられている。したがってドミノ倒しのように、一か所が破壊されれば壊滅的な崩壊を引き起こす可能性がある。
◆細胞消失
この新たな研究を報告した研究者らは、マウスの視床下部を研究した。視床下部はしばらく前から加齢を抑制する脳の部位として知られており、脳の中心部にあるこのアーモンド粒大の構造は、神経系や内分泌(ホルモン)系とつながっている。視床下部は空腹、睡眠、恐れ、攻撃などの多くの基本的なニーズや行動の調整を助ける。人間の脳の行動の開始は通常複雑だが、抑えきれないパニックや激しい怒りに襲われた時などは、一時的に視床下部が支配権を握る。
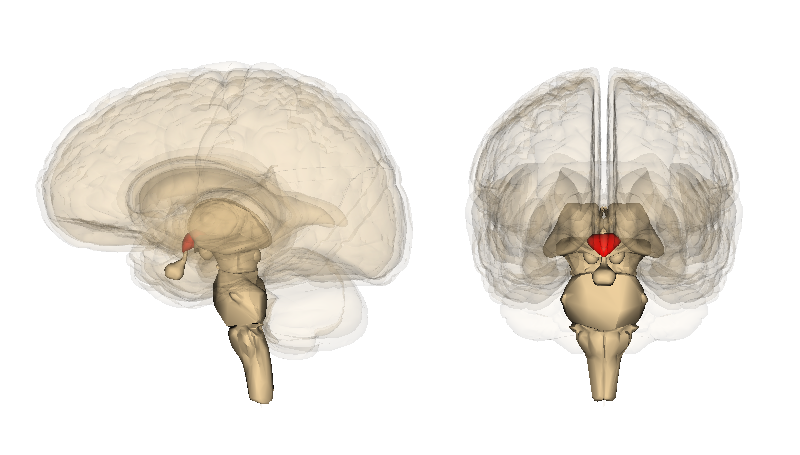
チームは視床下部内の幹細胞の特定群を観察し、加齢マウス群の経過を監視した。通常、マウスは約2年間生存するが、月齢約11か月までに幹細胞が消失し始めることを突き止めた。そして月齢22か月までに幹細胞は完全に消失した。幹細胞の消失率は学習能力、記憶力、社交性、筋持久性、運動能力の衰退などマウスの加齢による変化と密接に相関していた。
ただし相関関係があるからといって因果関係があるということではない。上記の衰退が加齢による変化をもたらしたのかどうかを突き止めるために、研究者らは医薬品ガンシロビルの中で、ウイルスを使って幹細胞を除去した。ウイルスは特別の遺伝子操作により作られており、幹細胞だけを殺滅する。月齢15か月のマウスにこの複合薬を投与したところ、視床下部の幹細胞の70%が破壊された。その結果、マウスは早くから加齢の兆候を示し始め、通常より約200日早く死亡した。約730日しか生きられないマウスとしてこれは有意な数値である。
研究グループは生まれたばかりのマウスから中齢マウスまでに同様に視床下部の幹細胞を移植した。このケースではマウスは一層社交的になり、より優れた認識能力を示し、通常より約200日も長く生きた。
上記の実験は、視床下部の幹細胞が最初にどのように消失するかについてもヒントを提供してくれた。幹細胞が炎症に耐性を示すように遺伝子操作された場合のみ、移植が機能した。マウスの加齢と共に、視床下部内の軽度の炎症が進行したものと思われる。
この炎症は、老化細胞の蓄積、または周囲の神経細胞が老化に近い状態になったことのいずれかによって引き起こされた可能性がある。視床下部の幹細胞は最も損傷を受けやすいため、炎症により幹細胞が死滅している。これが次に組織全体の連鎖反応により視床下部の機能を妨げている。すなわちドミノ倒し状態である。
◆不老不死の妙薬?
老化の研究の究極の目標は、人の晩年の健康を増進する医薬品のターゲットまたは生活様式への介入を見つけ出すことだ。今回はマウスを使った研究であるが、人の場合も同じメカニズムが機能することを証明することができれば、いつか人の晩年の健康増進に同様の技術を用いることができるだろう。ただし、これには将来的にまだまだ課題が多い。
老化細胞除去などの処置もマウスの寿命を最大180日延長し、健康を増進させている。論理的には次の段階はこのような処置を「積み重ねる」ことが可能かどうかだ。
この研究は、視床下部の幹細胞が細胞の機能の仕方に関する多くの側面を制御するmiRNA(マイクロRNA)分泌を通して主な効果を発揮していることも示している。miRNAは短いノンコーディングRNAで、DNAよりは簡易だが情報をコード化する能力をもつ分子だ。幹細胞を欠くマウスにmiRNAを投与した時、マウスは幹細胞治療を受けていたマウスと同様の症状の改善を示した。
miRNAの医薬品としての提供はいまだ揺籃期にあるが、この研究は視床下部の幹細胞剥皮を補充する潜在的な経路を示唆している。すなわち、炎症を制御することによりまず幹細胞の損失を予防することができる。これは、老化細胞殺滅の医薬品開発または抗炎症性化合物の使用を通して達成される可能性がある。
この研究は、異なる健康維持のメカニズムがいかに相互作用を及ぼしているかをすっきりと示しているという点で重要だ。ただ、オスのマウスしか用いられていないなどのマイナス面もある。視床下部の構造は異性間で大きく異なっていることはよく知られている。寿命を延長する医薬品や変異体も通常男女間で顕著に異なる有効性を示している。
人類が現在の最高125歳という寿命よりはるかに長く生きることができるようになるかどうかは分からない。しかし、健康的な晩年に対する最大の障壁はもはや進歩の速さではなく、老化の生物学に対してますます深まる知識を医薬品や生活様式に対する助言に変えていくスピードだということは言えるかもしれない。
This article was originally published on The Conversation. Read the original article.
Translated by サンチェスユミエ
![]()





